Power Point de apuntes sobre modelos atómicos.
Para repasar los conceptos trabajados en clase sobre la estructura atómica y propiedades periódicas, pincha aquí.
Si quieres saber más sobre los orbitales atómicos pincha aquí.
Repasa los modelos atómicos.
LOS NÚMEROS CUÁNTICOS
Los cuatro números cuánticos n, l m y s permiten identificar plenamente al electrón en cualquier orbital de cualquier átomo. Si hacemos una analogía, los cuatro números cuánticos nos dan el "domicilio" de un electrón en un átomo, al igual que una calle, una dirección postal, la ciudad etc, nos dan la información del domicilio de una persona. Por lo general este "domicilio" se expresa como ( n, l, m, s).
Ejemplo: si damos la siguiente información ( 2, 0, 0, +1/2), estaremos informando que ese electrón se encuentra en el nivel cuántico principal n=2, en un orbital s (l=0), con un m=0 y se representa con una flecha hacia arriba.
El número cuántico principal, n, nos indica el nivel de energía del electrón y toma los valores 1, 2, 3, 4,...
El número cuántico secundario, l, nos indica el orbital y toma los valores comprendidos desde cero a n-1.
Si l=0 se trata del orbital s:
Si l= 1 el orbital es de tipo p:
Si l= 2, el orbital es de tipo d:
Si l= 3, el orbital es de tipo f:
El número cuántico m indica la orientación del orbital en un campo magnético y toma los valores comprendidos desde -l a +l.
El número cuántico s indica el sentido de giro del electrón sobre sí mismo y puede valer +1/2 y -1/2.
CONFIGURACIÓN ELECTRÓNICA DE UN ÁTOMO
Se llama configuración electrónica de un átomo a la distribución de sus electrones en los distintos orbitales y niveles. Para conocer la distribución electrónica de un elemento hay que tener en cuenta lo siguiente:
A) Principio de exclusión de Pauli: dos electrones no pueden tener iguales los cuatro números cuánticos.
Si dos electrones tienen iguales n, l y m y por tanto se encuentran en el mismo orbital, es necesario que un electrón tenga un s =+1/2 y el otro un s = -1/2.
B) Principio de Aufbau: Los electrones pasan a ocupar los orbitales de menor energía, y progresivamente se van llenando los orbitales de mayor energía.
Según el principio de Aufbau, la configuración electrónica de un átomo se expresa mediante la secuencia siguiente:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d…
La regla del serrucho nos ayuda a llenar adecuadamente esta serie.
C) Regla de Hund:
Cuando los electrones ocupan orbitales de igual energía, lo hacen de manera que ocupen el mayor número de orbitales posible. Esta distribución es lógica teniendo en cuenta que al situarse los electrones en regiones distintas, las repulsiones entre ellas son menores.
Los orbitales con igual nivel de energía ( se refiere a orbitales con el mismo número cuántico n y el mismo número cuántico l), se llenan progresivamente de manera que siempre exista un mayor número de electrones desapareados.
Cuando los electrones ocupan orbitales de igual energía, lo hacen de manera que ocupen el mayor número de orbitales posible. Esta distribución es lógica teniendo en cuenta que al situarse los electrones en regiones distintas, las repulsiones entre ellas son menores.
Los orbitales con igual nivel de energía ( se refiere a orbitales con el mismo número cuántico n y el mismo número cuántico l), se llenan progresivamente de manera que siempre exista un mayor número de electrones desapareados.
EL ENLACE QUÍMICO:
Llamamos enlace químico a la fuerza responsable de la unión estable entre los iones, átomos y moléculas que forman las sustancias.
El tipo de enlace depende de la configuración electrónica. En general, los átomos tienden a completar su capa de valencia con 8 electrones, imitando a los gases nobles, para alcanzar mayor estabilidad, ganando, cediendo o compartiendo electrones.
Hay tres tipos de enlace químico: iónico, covalente y metálico.
EL ENLACE IÓNICO
Tiene lugar entre un elemento metálico y otro no metálico.
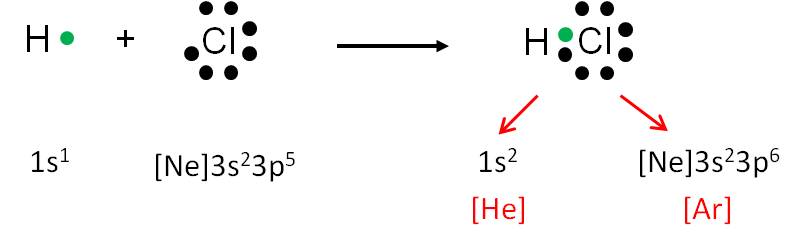
Se produce cuando la diferencia de electronegatividad entre los átomos es grande, principalmente entre los elementos del grupo I A (1) o II A (2) con los elementos del grupo VIA (16) o VII A (17). El metal cede electrones al no metal, dando lugar a iones. Por ejemplo, el
átomo Na forma un catión Na+ cuando cede al Cl su único electrón en el nivel 3s, que pasa a completar el nivel 3p del Cl, donde antes había 5 electrones, formando ahora el anión Cl–.
El compuesto resultante es el cloruro sódico (sal común).
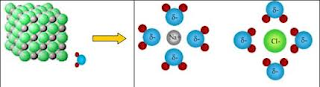
La fuerza que une a los iones es electrostática y, por tanto, elevada. Ello supone que los compuestos iónicos sean sólidos, integrados por redes tridimensionales regulares donde se hallan dispuestos los iones. Es lo que se conoce como estructura cristalina.
Se entiendo por energía reticular a la energía desprendida al formarse un mol de cristal a partir de los iones en estado gaseoso.
Cuanto mayor sea (en valor absoluto), mayor estabilidad tendrá el cristal.
Cuanto mayor carga y menor radio tengan los iones, mayores serán las fuerzas atractivas de estos en el cristal y, en consecuencia, mayor será la energía reticular.
Propiedades de las sustancias iónicas:
Son sólidos integrados por iones dispuestos regularmente en una red tridimensional. La naturaleza de la unión entre los iones es de tipo electrostático y, por ello fuerte, lo cual implica un elevado punto de fusión.
Se disuelven en agua. Las moléculas de agua causan la rotura de la red cristalina por efecto de la interacción entre los iones y los dipolos del agua.
Son duros, aunque quebradizos, esto es, se rompen fácilmente al golpearlos. Ello se explica según su estructura cristalina. Cuando se golpea una zona del cristal los planos de iones se desplazan lo suficiente como para enfrentar entre si iones del mismo signo, que se repelen y provocan la separación de ambos planos. Como resultado, se quiebra el cristal.
En estado solido son malos conductores de la electricidad, pues los electrones se hallan muy sujetos en los iones y estos no poseen apenas movilidad. No obstante, en estado fundido o disueltos en agua los iones pueden moverse, lo que produce una alta conductividad.
En estado solido son malos conductores de la electricidad, pues los electrones se hallan muy sujetos en los iones y estos no poseen apenas movilidad. No obstante, en estado fundido o disueltos en agua los iones pueden moverse, lo que produce una alta conductividad.
Disolución de una sal en agua (animación)
EL ENLACE COVALENTE
Según Lewis, los no metales pueden formar enlaces simples, dobles o triples.
Por ejemplo, el átomo de Cl tiene 7 electrones de valencia, representados por puntos en el diagrama de Lewis, por lo que al constituir la molécula Cl2, lo harán compartiendo un par de electrones.
Representa los diagramas de Lewis de
PH3, SH2, PBr3, CH4, SCl2, HCN, CO2
Ver soluciones.
PROPIEDADES DE LOS COMPUESTOS COVALENTES
Las sustancias polares presentan una alta solubilidad en agua si pueden formar puentes de hidrógeno. Ver apartado el agua de este blog (apuntes).
Las sustancias covalentes atómicas son sólidos cuyos átomos se encuentran unidos por enlaces covalentes, aunque no existen moléculas individuales sino una red atómica tridimensional (cristal atómico covalente). Dada la fuerza elevada del enlace covalente estas sustancias tienen unos puntos de fusión muy altos y son insolubles, puesto que romper sus enlaces implica un gran
consumo de energía. Algunos ejemplos son la sílice (SiO2), el diamante y los elementos de la diagonal de
POLARIDAD
Las moléculas formadas por átomos iguales tienen las cargas uniformemente distribuidas y no presentan polaridad. Decimos que un enlace es apolar cuando los electrones se comparten por igual por los dos átomos y la densidad electrónica es simétrica respecto a ambos núcleos.
Cuando los dos átomos enlazados no tienen igual electronegatividad, uno de ellos atrae hacia sí con mayor fuerza los electrones del par compartido, lo que origina un dipolo eléctrico. En definitiva, el enlace es polar. Así, la molécula de cloro es apolar, mientras que el enlace HCl es covalente polar. El caso límite de un enlace covalente polar es el enlace iónico, como en Na Cl. En las situaciones intermedias, la mayoría, cabe hablar de enlaces parcialmente iónicos, según su grado de polaridad.
El amoniaco:
La fórmula del amoniaco es NH3.
Un átomo de nitrógeno tienen cinco electrones en la última capa y necesita tres más para completarla. La formación de tres enlaces covalentes con tres átomos de hidrógeno se los proporciona.
Según la teoría de repulsión entre pares de electrones de la capa de valencia, los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un tetraedro, distribución característica cuando existe hibridación sp3. Existe un par solitario, por lo que la geometría de la molécula es piramidal trigonal.
EL ENLACE COVALENTE
Se produce entre elementos no metálicos, que tienen tendencia a ganar electrones, por lo que la única forma de adquirir la configuración de un gas noble es compartir electrones.
El enlace covalente consiste en la unión de dos átomos que comparten uno o más pares de electrones.
En 1923, Lewis propuso la regla del octeto, según la cual, los átomos tienden a alcanzar ocho electrones en su capa de valencia.
El enlace covalente suele representarse mediante un diagrama de puntos que se conoce como diagrama de Lewis o estructura de Lewis. Es una forma de representar los electrones de la capa externa en la que se escribe el símbolo del elemento y alrededor se dibujan los electrones de la capa externa como puntos y el enlace como una raya.Según Lewis, los no metales pueden formar enlaces simples, dobles o triples.
Por ejemplo, el átomo de Cl tiene 7 electrones de valencia, representados por puntos en el diagrama de Lewis, por lo que al constituir la molécula Cl2, lo harán compartiendo un par de electrones.
El cloro, un elemento del grupo 7, debe formar un enlace covalente para alcanzar la configuración de gas noble.
El oxígeno, un elemento del grupo 6, debe formar dos enlaces covalentes para alcanzar la configuración del gas noble (enlace doble)
El nitrógeno, elemento del grupo 5, forma tres enlaces covalentes (enlace triple).
Representemos ahora la formación de la molécula de H Cl (ácido clorhídrico):

La compartición del par de electrones permite que cada átomo tenga configuración de gas noble: el hidrógeno tiene alrededor de él dos electrones (configuración electrónica del helio), mientras que el cloro está rodeado de ocho electrones (configuración electrónica del argón).
Ahora intenta elaborar tú los diagramas de Lewis del agua, del etileno, C2 H4
y acetileno, C2 H2
Ahora intenta elaborar tú los diagramas de Lewis del agua, del etileno, C2 H4
y acetileno, C2 H2
Comprueba los resultados:
Representa los diagramas de Lewis de
PH3, SH2, PBr3, CH4, SCl2, HCN, CO2
Ver soluciones.
PROPIEDADES DE LOS COMPUESTOS COVALENTES
Cuando se unen varios átomos entre sí por enlaces covalentes se forma una molécula. En general, si no existen fuerzas de unión entre ellas, o son muy débiles, las sustancias moleculares son gases a temperatura ambiente, con bajos puntos de fusión y ebullición. Así ocurre con Cl2, N2, H2, O2, etc. Estas sustancias no son solubles en agua, pero se disuelven bien en disolventes apolares o poco polares, como éter, cloruro de carbono, sulfuro de carbono, etc. Son malos conductores del calor y de la electricidad.
Si estas fuerzas intermoleculares son más fuertes, las sustancias covalentes serán líquidos, como el agua, o sólidas, como el iodo.Las sustancias polares presentan una alta solubilidad en agua si pueden formar puentes de hidrógeno. Ver apartado el agua de este blog (apuntes).
Las sustancias covalentes atómicas son sólidos cuyos átomos se encuentran unidos por enlaces covalentes, aunque no existen moléculas individuales sino una red atómica tridimensional (cristal atómico covalente). Dada la fuerza elevada del enlace covalente estas sustancias tienen unos puntos de fusión muy altos y son insolubles, puesto que romper sus enlaces implica un gran
consumo de energía. Algunos ejemplos son la sílice (SiO2), el diamante y los elementos de la diagonal de
la tabla periódica: B, C, Si, Ge, As...Estos cristales no conducen la electricidad dado que no tienen electrones libres.
En el cuarzo, cada átomo de silicio está unido a cuatro átomos de oxígeno y cada átomo de oxígeno se une a dos de silicio formando una gran red tridimensional.
En el cuarzo, cada átomo de silicio está unido a cuatro átomos de oxígeno y cada átomo de oxígeno se une a dos de silicio formando una gran red tridimensional.
En el diamante, los átomos de carbono se sitúan en forma de red tridimensional extraordinariamente resistente que se extiende en todas las direcciones, lo que lo hace una de las sustancias más duras el mundo (grado 10 de dureza en la escala de Mohs) y con un elevadísimo punto de fusión.
En el grafito, los átomos de carbono se colocan formando anillos de seis, estando cada átomo unido a otros tres por enlaces covalentes, por lo que quedan electrones en libertad de movimiento, lo que explica que sea conductor de la electricidad.
Los compuestos covalentes reticulares son muy duros, con altos puntos de fusión y ebullición, no conducen la electricidad ni el calor y prácticamente insolubles en cualquier disolvente.
El iodo está formado por moléculas unidas entre sí formando un cristal tridimensional (cristal molecular covalente). Como las fuerzas de atracción entre ellas son débiles, el cristal se puede romper fácilmente.
El iodo está formado por moléculas unidas entre sí formando un cristal tridimensional (cristal molecular covalente). Como las fuerzas de atracción entre ellas son débiles, el cristal se puede romper fácilmente.
POLARIDAD
Las moléculas formadas por átomos iguales tienen las cargas uniformemente distribuidas y no presentan polaridad. Decimos que un enlace es apolar cuando los electrones se comparten por igual por los dos átomos y la densidad electrónica es simétrica respecto a ambos núcleos.
Cuando los dos átomos enlazados no tienen igual electronegatividad, uno de ellos atrae hacia sí con mayor fuerza los electrones del par compartido, lo que origina un dipolo eléctrico. En definitiva, el enlace es polar. Así, la molécula de cloro es apolar, mientras que el enlace HCl es covalente polar. El caso límite de un enlace covalente polar es el enlace iónico, como en Na Cl. En las situaciones intermedias, la mayoría, cabe hablar de enlaces parcialmente iónicos, según su grado de polaridad.
Conviene distinguir entre polaridad de un enlace y polaridad de una molécula. Una molécula puede ser apolar a pesar de contener enlaces polares, siempre que los dipolos se anulen entre si. Un ejemplo de ello es la molécula plana de tricloruro de boro. Cada enlace B–Cl es polar, pero, debido a la simetría, los dipolos se anulan.
Si la suma vectorial de los momentos dipolares de todos los enlaces da un momento dipolar resultante, la molécula será polar. Esto le sucede a la molécula de amoniaco, en forma de pirámide triangular, que tiene un momento dipolar resultante. Una prueba de que la molécula de agua es angular nos la suministra su polaridad. Si la molécula tuviese una estructura lineal, H–O–H, los momentos dipolares de ambos enlaces se anularían mutuamente, haciéndola apolar, en contra de lo que se observa.El amoniaco:
La fórmula del amoniaco es NH3.
Un átomo de nitrógeno tienen cinco electrones en la última capa y necesita tres más para completarla. La formación de tres enlaces covalentes con tres átomos de hidrógeno se los proporciona.
Según la teoría de repulsión entre pares de electrones de la capa de valencia, los pares electrónicos de valencia del nitrógeno en la molécula se orientan hacia los vértices de un tetraedro, distribución característica cuando existe hibridación sp3. Existe un par solitario, por lo que la geometría de la molécula es piramidal trigonal.
ENLACE METÁLICO
Un metal está formado por un solo elemento de la tabla periódica. Son metales el hierro, el oro, el plomo, la plata, el cobre, el estaño, el calcio, el sodio, etc. El enlace metálico es la fuerza de unión entre los átomos de los metales, a la que deben su estabilidad y
propiedades las redes cristalinas metálicas.
Los metales tienden, por su baja energía de ionización, a perder electrones. Por tanto, podríamos considerar a un átomo metálico como un catión unido al electrón de valencia que podría perder. En un metal tenemos muchísimos átomos unidos entre sí. Entonces, podemos considerar a un metal como un conjunto de cationes metálicos inmersos en un mar de electrones de valencia deslocalizados. La atracción electrostática entre carga positiva (del catión) y negativa (del electrón) mantiene fuertemente unidos a todos los átomos del metal.
Los metales tienden, por su baja energía de ionización, a perder electrones. Por tanto, podríamos considerar a un átomo metálico como un catión unido al electrón de valencia que podría perder. En un metal tenemos muchísimos átomos unidos entre sí. Entonces, podemos considerar a un metal como un conjunto de cationes metálicos inmersos en un mar de electrones de valencia deslocalizados. La atracción electrostática entre carga positiva (del catión) y negativa (del electrón) mantiene fuertemente unidos a todos los átomos del metal.
Los metales tienen las siguientes propiedades:
Aquí puedes estudiar fácilmente los tipos de enlace químico.
- Brillo: reflejan el haz de luz.
- Maleabilidad: capacidad de formar láminas.
- Ductilidad: capacidad para ser esturados formando hilos.
- Conductividad térmica: conducen el calor, por eso son fríos al tacto.
- Conductividad eléctrica: movimiento ordenado de electrones frente a un campo eléctrico.
El modelo del mar de electrones explica de manera sencilla las propiedades de los metales. La ductilidad y maleabilidad ocurre debido a que la deslocalización de electrones ocurre en todas las direcciones a manera de capas. Por tanto, ante un esfuerzo externo, estas capas se deslizan unas sobre otras, sin que se rompa la estructura. Por otro lado, dado que los electrones son móviles, permiten el flujo de corriente eléctrica, explicándose la conductividad eléctrica. Asimismo, ese movimiento de electrones puede conducir calor, transportando energía cinética de una parte a otra del metal.
FUERZAS INTERMOLECULARES
Son las fuerzas de atracción entre las moléculas de las sustancias covalentes. Existen cuando
las sustancias se hallan en estado sólido o líquido y disminuyen sensiblemente en el estado gaseoso.
Pueden ser de dos tipos: fuerzas de Van der Waals y enlace de hidrogeno.
Las fuerzas de Van der Waals son electrostáticas. Una de ellas son las fuerzas dipolo–dipolo, que se dan entre moléculas
polares y aumentan conforme es mayor el momento dipolar.
El enlace de hidrógeno (o puente de hidrogeno) es un tipo especial de fuerzas dipolo–dipolo entre un átomo de hidrógeno de una
molécula y un átomo muy electronegativo, como F, O, N y Cl de otra. A ello se debe que sustancias moleculares como el agua sean líquidas a temperatura ambiente.
Aquí puedes ver una presentación en powerpoint de lo estudiado sobre los enlaces químicos y sus propiedades.
ACTIVIDADES DE REPASO
1. ¿Por qué a temperatura ambiente el agua es líquida mientras que el sulfuro de hidrogeno, de mayor masa molecular, es gaseoso?
2. Dados los siguientes compuestos: CaF2, CO2, H2O.
a) Indica el tipo de enlace predominante en cada uno de ellos.
b) Ordena los compuestos anteriores de menor a mayor punto de ebullición. Justifica las respuestas.
3. ¿Por qué el dióxido de carbono es un gas en condiciones estándar y la sílice es un sólido muy duro?
4. Dadas las siguientes sustancias, plata, bromuro de hidrógeno, sulfato potásico, sílice (dióxido de silicio) y dióxido de azufre, indica:
a) El tipo de sustancia que es, según su enlace.
b) La más soluble en agua y por qué.
c) La de mayor punto de fusión y por qué.
d) La que es buena conductora en estado puro.
5. Cuatro elementos se designan arbitrariamente como A, B, C y D. Sus electronegatividades se muestran en la tabla siguiente:
Elemento
|
A
|
B
|
C
|
D
|
Electronegatividad
|
3
|
2,8
|
2,5
|
2,1
|
Si se forman las moléculas AB, AC, AD y BD,
a) Clasifícalas en orden creciente por su carácter covalente.
b) ¿Cuál será la molécula más polar? Justifica las respuestas.
|
Sustancia
|
Punto de fusión (ºC)
|
Conductividad eléctrica
|
Solubilidad en agua
| |
|
|
|
Sólido
|
líquido
|
|
|
A
|
112
|
no
|
no
|
no
|
|
B
|
680
|
No
|
SÍ
|
SÍ
|
|
C
|
1610
|
No
|
no
|
no
|
|
D
|
660
|
No
|
Sí
|
sí
|
|
E
|
1700
|
sí
|
si
|
no
|
a) ¿Cuál es un compuesto iónico?
b) ¿Cuál de estas sustancias es un compuesto covalente?
c) ¿Cuál de ellas tienen un elevado punto de fusión comparado con el resto? ¿Por qué no se trata un compuesto iónico?
c) ¿Cuál de ellas tienen un elevado punto de fusión comparado con el resto? ¿Por qué no se trata un compuesto iónico?



















Thanks for sharing, nice post! Post really provice useful information!
ResponderEliminarGiaonhan247 chuyên dịch vụ chuyên dịch vụ mua hàng trên Amazon ship về Việt Nam uy tín, dịch vụ ebay vn nhanh chóng và dịch vụ order hàng Mỹ uy tín.